A. STRUKTUR ATOM
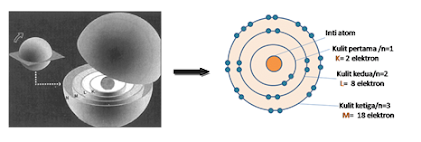
Masih ingatkah kalian dengan model atom yang dikemukakan oleh Ernest Rutherford (1871–1937). Menurut Rutherford, atom terdiri dari inti yang bermuatan positif dan dikelilingi elektron yang bermuatan negatif. Namun, jika suatu partikel yang bermuatan listrik bergerak melingkar akan mengemisikan energinya dalam bentuk cahaya yang mengakibatkan percepatan partikel semakin berkurang dan akhirnya diam. Dengan demikian, jika elektron yang bermuatan negatif bergerak melingkar (mengelilingi inti bermuatan positif) maka akan kehilangan energinya sehingga gerakan elektron akan berkurang, yang akhirnya akan jatuh ke inti. Namun pada kenyataannya, elektron tidak jatuh ke inti. Rutherford tidak mampu menjelaskan mengapa elektron tidak dapat jatuh ke inti. Teori atom ini kemudian disempurnakan oleh Niels Bohr (1885 – 1962) sehingga model atom menurut Bohr adalah sebagai berikut.
- Atom terdiri atas inti yang proton bermuatan positif dan neutron yang tidak bermuatan (netral).
- Inti atom dikelilingi oleh elektron yang bermuatan negatif di dalam suatu lintasan/orbit tertentu yang biasa disebut kulit atom.
- Pada atom setiap lintasan (kulit) dapat ditempati lebih dari 1 elektron.
- Kulit atom merupakan gerakan stasioner (menetap) dari elektron dalam mengelilingi inti atom dengan jarak tertentu. Selama elektron berada pada lintasan stasioner tertentu, energi elektron tetap sehingga tidak ada energi yang diemisikan atau diserap.
- Setiap kulit atom memiliki tingkat energi
tertentu. Makin besar nomor kulit, tingkat energinya juga makin besar.
- Berdasarkan
struktur atom Bohr, elektron tidak akan memancarkan atau menyerap energi jika
dia berada pada lintasannya (keadaan dasar) ® stabil.
Namun, elektron dapat berpindah dari kulit satu ke kulit lainnya dengan cara
melepas atau menyerap energi.
- Jika elektron berpindah dari kulit dengan energi rendah ke kulit yang energinya lebih tinggi, maka ia akan menyerap energi (eksitasi)
- jika elektron berpindah dari kulit dengan energi tinggi ke kulit yang energinya lebih rendah maka ia akan melepaskan/membebaskan energy (emisi)
- Dimulai dari lintasan yang terdekat dengan inti, masing-masing lintasan disebut kulit ke-1, kulit ke-2, kulit ke-3, kulit ke-4, dan seterusnya.
- Jumlah elektron maksimum (paling banyak) yang dapat menempati masing-masing kulit adalah: 2n, dengan n = nomor kulit
Kulit
1 dapat menampung maksimal 2 elektron.
Kulit
2 dapat menampung maksimal 8 elektron.
Aturan penulisan
konfigurasi elektron suatu unsur :
Ø Hitung jumlah elektron ( pada atom bebas, jumlah elektron =
nomor atom)
Ø Pengisian elektron dimulai dari kulit K, L, M, N dan seterusnya.
Ø Setiap kulit diisi elektron sebanyak jumlah maksimal elektron
(2n2) dan menghitung jumlah elektron yang tersisa.
Ø Jika elektron yang tersisa kurang dari jumlah elektron maksimal
suatu kulit maka diisi sesuai jumlah elektron maksimal kulit sebelumnya.
Ø Jika elektron yang tersisa < 8, maka ditempatkan pada kulit
berikutnya sebagai elektron terluar atau disebut sebagai elektron valensi.
Ø Jumlah maksimal elektron valensi adalah 8.
Kelebihan
dan Kelemahan Atom Bohr
Kelebihan
: dapat menjelaskan adanya lintasan elektron pada atom sehingga elektron tidak
jatuh ke inti.
Pada struktur atom
menurut Bohr, dapat dilihat bahwa elektron dalam atom hanya dapat beredar pada
lintasan-lintasan dengan tingkat energi tertentu. Pada lintasan itu, electron
dapat beredar tanpa pemancaran atau penyerapan energi. Lintasan elektron
tersebut berupa lingkaran dengan jari-jari tertentu yang disebut sebagai kulit
atom.
Sedangkan pada
Model atom mekanika kuantum menerangkan bahwa elektron-elektron dalam atom
menempati suatu ruang atau “awan” yang disebut orbital, yaitu ruang
tempat elektron paling mungkin ditemukan. Beberapa orbital bergabung membentuk
kelompok yang disebut subkulit. Jika orbital kita analogikan sebagai
“kamar elektron”, maka subkulit dapat dipandang sebagai “rumah elektron”.
Beberapa subkulit yang bergabung akan membentuk kulit atau “desa elektron”.
Orbital-orbital dalam satu subkulit mempunyai tingkat energi yang sama,
sedangkan orbital-orbital dari subkulit berbeda, tetapi dari kulit yang sama
mempunyai tingkat energi yang mirip.
E. BILANGAN KUANTUM
Keberadaan elektron dalam atom dikaitkan dengan empat bilangan kuantum. Adapun keempat bilangan kuantum tersebut, yaitu bilangan kuantum utama, bilangan kuantum azimuth, bilangan kuantum magnetic dan bilangan kuantum spin.
a.
Bilangan Kuantum Utama (n)
Bilangan kuantum
utama (n) menentukan ukuran dari
orbital berdasarkan kulit/orbit. Bilangan kuantum ini menentukan tingkat energi
yang mempunyai harga n = 1, 2, 3, …..
Biasanya digunakan
istilah “kulit” yang menyatakan sekelompok tingkat energi yang memiliki n dengan harga yang sama.
b.
Bilangan Kuantum
Azimuth (l)
Bilangan kuantum
azimuth (l) disebut juga bilangan
kuantum orbital yang dapat menentukan
bentuk
ruang dari orbital. Harga l biasanya
dinyatakan dengan huruf sebagai berikut.
l
=
0, yaitu s (sharp)
l
=
1, yaitu p (principal)
l
=
2, yaitu d (diffuse)
l
=
3, yaitu f (fundamental)
Nilai s, p, d, f digunakan dari spektroskopi
deret-deret spectrum unsur alkali. Dengan adanya bilangan kuantum azimuthh
(orbital) yang berbeda memungkinkan untuk membagi setiap “kulit” menjadi
“subkulit” atau orbital. Setiap subkulit dinyatakan dengan harga bilangan dari n dan huruf yang menyatakan l. Misalkan, subkulit 2p berarti mempunyai harga n = 2 dan l = 1.
c.
Bilangan Kuantum
Magnetik (m)
Bilangan kuantum
magnetik (m) menentukan orientasi
orbital dalam ruang sehingga disebut juga bilangan kuantum orientasi orbital.
Untuk setiap harga l, akan mempunyai
harga m dengan rentang nilai m = …, - l, 0, + l,….
Untuk l = 0 (elektron pada s) maka m = 0
Untuk l = 1 (elektron pada p) maka m = -1, 0, +1
Untuk l = 2 (elektron pada d) maka m = -2, -1, 0, +1, +2
Untuk l = 3 (elektron pada f) maka m = -3, -2, -1, 0, +1, +2, +3
d.
Bilangan Kuantum Spin (s)
Dengan menggunakan alat spektroskopi yang daya pisahnya sangat tinggi maka akan tampak setiap garis spectrum yang terdiri atas sepasang garis yang sangat berdekatan. Menurut Uhlenbeck dan Goudsmit (1925) bahwa elektron memiliki momen magnetik sehingga elektron berputar pada sumbu-sumbu dan menghasilkan sudut spin. Harga bilangan kuantum spin (s) adalah +½ dan -½.
F. ORBITAL MOLEKUL
Orbital (bukan orbit)
adalah volume ruang yang memiliki kebolehjadian paling besar untuk menemukan
elektron dalam atom. Setiap orbital dicirikan oleh 3 bilangan kuantum n, l,
dan m, dimana orbital mempunyai
ukuran, bentuk, dan orientasi tertentu dalam ruang.
Kumpulan orbital-orbital dengan bilangan kuantum utama (n) yang sama disebut kulit. Jumlah orbital dalam kulit dapat ditentukan dengan rumus n2.
a.
Orbital s
Bentuk orbital s berupa bola simetris dan hanya memiliki 1 macam orbital. Bentuk orbitalnya dapat dilihat pada Gambar. 1.2
b.
Orbital p
Orbital p berjumlah tiga buah yang terletak di subkulit p. ketiganya mempunyai tingkat energi yang sama, namun arah ruangnya berbeda. Ketiga orbital tersebut, yaitu Px, Py dan Pz. Setiap orbital berbentuk seperti balon terpilin yang digambarkan menggunakan koordinat Cartesius dengan sumbu x, y dan z, seperti pada Gambar 1.3
a.
Orbital d
Konfigurasi
elektron merupakan gambaran penyebaran elektron yang paling mungkin ke dalam
orbital-orbital kulit elektron. Menurut prinsip Aufbau, pengisian orbital
dimulai dari tingkat energi yang rendah sampai penuh kemudian tingkat energinya lebih tinggi.
Elektron mempunyai
kecenderungan akan menempati dulu subkulit yang energinya rendah. Besarnya
tingkat energi dari suatu subkulit dapat diketahui dari bilangan kuantum utama
(n) dan bilangan kuantum azimuth ( l ) dari orbital tersebut. Orbital dengan
harga (n + l) lebih besar mempunyai tingkat energi yang lebih besar. Jika harga
(n + l) sama, maka orbital yang harga n-nya lebih besar mempunyai tingkat
energi yang lebih besar.
H. DIAGRAM ORBITAL
Diagram orbital menunjukkan sebaran elektron dalam orbital-orbital
pada suatu atom. Penggambaran diagram orbital pada umumnya menggunakan kotak
yang mewakili jumlah orbital pada setiap subkulit disertai dengan tanda panah
ke atas (↿) atau ke bawah (⇂) yang menggambarkan spin
elektron. Diagram orbital umumnya hanya dituliskan untuk elektron valensi.
Setiap orbital mempunyai ukuran, bentuk, dan arah orientasi ruang yang ditentukan oleh bilangan kuantum n, l, m, dan s. Orbital-orbital bergabung membentuk suatu subkulit, kemudian subkulit bergabung membentuk kulit dan tingkat energi.
Untuk memudahkan penentuan nilai bilangan-bilangan kuantum suatu elektron, Konfigurasi elektron terlebih dahulu diubah menjadi diagram orbital. Ada beberapa aturan yang harus dipenuhi dalam menggambarkan diagram orbital, diantaranya :
1.
Larangan Pauli
Larangan Pauli menyatakan bahwa di dalam satu atom tidak
boleh terdapat dua elektron dengan empat bilangan kuantum yang sama. Dua
elektron yang menempati satu orbital (mempunyai bilangan kuantum utama, azimut,
magnetik yang sama), harus mempunyai spin yang berbeda. Jadi, setiap orbital hanya dapat berisi 2 elektron dengan
spin (arah putaran) yang berlawanan
Dengan adanya larangan Pauli, maka elektron
yang dapat menempati suatu subkulit terbatas hanya dua kali dari jumlah
orbitalnya. Dengan demikian, jumlah maksimum elektron adalah sebagai berikut:
Friedrich Hund (1927), seorang ahli fisika dari
Jerman mengemukakan aturan pengisian elektron pada orbital yaitu :
“orbital-orbital dengan energi yang sama, masing-masing diisi lebih
dulu oleh satu elektron arah (spin) yang sama atau setelah semua orbital
masing-masing terisi satu elektron kemudian elektron akan memasuki
orbital-orbital secara urut dengan arah (spin) berlawanan”
Konfigurasi
elektron suatu unsur harus menggambarkan sifat suatu unsur. Hasil eksperimen
menunjukkan bahwa sifat unsur lebih stabil apabila orbital dalam suatu atom unsur terisi elektron tepat setengah penuh atau
tepat penuh,terutama orbital-orbital d dan f (5 elektron atau 10
elektron untuk orbital-orbital d dan 7 elektron atau 14 elektron untuk orbital-orbital f).
Contoh:
Konfigurasi elektron: 24Cr
24Cr:
1s2 2s2 2p6 3s2 3p6 4s1
3d5 atau disingkat 24Cr : [18Ar] 3d5
4s1
bukan: 1s2
2s2 2p6 3s2 3p6 4s2 3d4
Konfigurasi elektron: 29Cu
29Cu:
1s2 2s2 2p6 3s2 3p6 4s1
3d10 atau disingkat 29Cu : [18Ar] 3d10
4s1
bukan: 1s2
2s2 2p6 3s2 3p6 4s2
3d9
Konfigurasi elektron: 87Fr
87Fr :
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s1
atau disingkat 87Fr
: [86Rn] 7s1
- Contoh gambar orbital yang mungkin untuk atom karbon dengan 6 elektron
- Konfigurasi 1 dan 2 tidak melanggar larangan Pauli dan tidak melanggar aturan Hund, disebut dengan konfigurasi elektron keadaan dasar.
- Konfigurasi 3 dan 4 tidak melanggar larangan Pauli, tetapi melanggar aturan Hund, disebut dengan konfigurasi elektron keadaan tereksitasi.
- Konfigurasi 5 dan 6 melanggar larangan Pauli, disebut dengan konfigurasi elektron keadaan terlarang.
I. PENENTUAN BILANGAN KUANTUM ELEKTRON
Bilangan kuantum adalah
nilai yang menjelaskan kuantitas kekal dalam sistem dinamis. Bilangan kuantum
menggambarkan sifat orbital dan elektron dalam orbital. Ada empat bilangan
kuantum yang akan kita kenal, yaitu bilangan kuantum utama (n), bilangan kuantum Azimut (l), bilangan kuantum magnetic (m) dan bilangan kuantum spin (s). Penentuan bilangan kuantum ini ada
beberapa langkah:
Contoh: Na (Z= 11)
- Menuliskan konfigurasi elektron atom tersebut : 11Na: 1s2 2s2 2p6 3s1
- Membuat
diagram orbital yang ditempati oleh elektron valensi yang akan ditentukan
bilangan kuantumnya.
- Menentukan bilangan kuantum elektron valensi.
a. Menentukan bilangan kuantum utama (n) dari
elektron valensi, yaitu 3s1. Tingkat energi pada konfigurasi terakhir adalah 3,
maka bilangan kuantum utama (n) = 3
b. Menentukan bilangan kuantum azimuth (l). Pada
atom Na, elektron valensinya ada di subkulit s, maka l = 0
c. Menentukan bilangan kuantum magnetik (m). Pada
atom Na, jumlah elektron valensi hanya 1, maka harga (m) = 0
d. Menentukan bilangan kuantum spin (s)
berdasarkan pada orientasi atau arah panah terakhir pengisian orbital. Maka
atom Na memiliki nilai bilangan kuantum spin +![]() .
.
Jadi atom Na (Z = 11), elektron valensinya memiliki
bilangan kuantum n = 3, l = 0, m = 0, s = +½



























0 comments:
Post a Comment