A. Perkembangan sistem periodik unsur
1. Pengelompokan
unsur berdasarkan Lavoisier
Kelebihan
pengelompokkan unsur berdasarkan Lavoisier yaitu Antoine Lavoisier adalah orang pertama yang mengelompokan
unsur-unsur kimia berdasarkan sifat-sifatnya. Patut kita hargai, karena Tabel
Periodik yang dibuatnya dapat menjadi dasar penemuan Tabel Periodik selanjutnya.
Kelemahan
pengelompokkan unsur berdasarkan Lavoisier yaitu terlalu sederhana setelah munculnya beberapa unsur-unsur
baru, karena antara unsur- unsur logam sendiri masih terdapat banyak perbedaan
2.
Pengelompokan unsur menurut Triade
Dobereiner
Johann
Wolfgang Dobereiner (1780-1849) mencoba untuk mengelompokkan unsur-unsur
berdasarkan kenaikan masa atom. Johan
Wolfgang Dobereiner mengelompokkan unsur-unsur yang sangat mirip sifatnya.
Ternyata tiap kelompok terdiri dari tiga unsur, sehingga kelompok itu disebut
triad. Apabila unsur-unsur
dalam satu triad
disusun menurut kenaikan massa
atom relatifnya, ternyata massa atom maupun sifat-sifat unsur yang kedua
merupakan rata-rata dari
massa atom relatif unsur pertama dan ketiga.
Contohnya:
Sistem triad ini ternyata ada kelemahannya. Sistem ini kurang efisien karena ternyata ada beberapa unsur lain yang tidak termasuk dalam satu triad, tetapi mempunyai sifat-sifat mirip dengan triad tersebut. Selain itu juga, terbatasnya jumlah unsur-unsur yang dapat dikelompokkan dalam triade serta adanya kesulitan mengenai cara membedakan berat atom dan berat molekul.
3.
Pengelompokan unsur menurut Oktav
Newlands
Meskipun triade Dobereiner ini masih jauh dari sempurna, namun temuan ini mendorong orang untuk menyusun daftar unsurunsur lebih lanjut sesuai dengan sifat-sifatnya. John Newlands (1865) menemukan hubungan lain antara sifat unsur dengan massa atom relatif, sesuai dengan hukum yang disebutnya “hukum oktaf”. Ia menyusun unsur-unsur ke dalam kelompok tujuh unsur dan setiap unsur kedelapan mempunyai sifat yang mirip dengan unsur pertama, unsur kesembilan mirip dengan unsur kedua, dan seterusnya.. Newlands menyebut pengulangan sifat-sifat unsur secara periodic tersebut dengan hukum oktaf. Simpulan dari Daftar Newlands adalah: Sifat-sifat unsur merupakan pengulangan secara oktaf
Kelebihan pengelompokkan unsur berdasarkan Oktav Newlands yaitu lebih banyak unsur-unsur yang dapat digolongkan. Kelemahannya adalah pada unsur-unsur yang massanya cukup besar (>40), pengulangan sifat unsur tidak terjadi lagi. Selain itu tidak memperhitungkan letak unsur-unsur yang belum ditemukan dan terdapat banyak pasangan unsur yang terpaksa ditempatkan pada satu posisi daftar
4. Pengelompokan unsur menurut Meyer-Mendeleyev
Dengan adanya kelemahan pengelompokan unsur menurut Newlands, maka mendorong Julius Lothar Meyer (1870 dari Jerman)
menemukan hubungan yang lebih jelas antara sifat unsur dan massa atom relatif.
Ia menemukan keperiodikan sifat unsur-unsur, jika unsur-unsur disusun menurut
kenaikan massa atom relatif.
Dalam mempelajari keperiodikan unsur-unsur ia lebih menekankan pada sifat-sifat fisika. Meyer membuat grafik dengan mengalurkan volume atom unsur terhadap massa atom relatif. Volume atom unsur diperoleh dengan cara membagi massa atom relatif dengan kerapatan unsur. Grafik menunjukkan Struktur Atom dan Sistem Periodik bahwa unsur-unsur yang sifatnya mirip terletak pada bagian grafik yang mirip bentuknya. Misalnya Na, K, Rb terdapat di puncak grafik, ini menunjukkan bahwa ada hubungan antara sifat unsur dengan massa atom relatifnya. Mendeleyev mengungkapkan suatu hukum periodik yang berbunyi:
“Sifat unsur-unsur merupakan fungsi periodik dari massa atom relatifnya”
Kelebihan pengelompokan unsur menurut Meyer dan Mendeleev tersebut dibandingkan dengan Newlands adalah sifat kimia dan sifat fisika unsur dalam satu golongan berubah secara teratur. Dapat meramal sifat unsur yang belum diketemukan, yang akan mengisi tempat kosong dalam daftar.
Sedangkan kelemahannya adalah panjang periode tidak sama, Triade besi (Fe, Co, dan Ni), triade platina ringan (Ru, Rh, dan Pd), dan triade platina (Os, Ir, dan Pt) dimasukkan ke dalam golongan VIII selain itu selisih massa atom relatifnya antara dua unsur yang berurutan tidak teratur (antara –1 dan +4), sehingga sukar untuk meramal unsur-unsur yang belum ditemukan.
5.
Pengelompokan unsur menurut Moseley
(Sistem Periodik Modern)
Henry
Moseley melakukan
percobaan menggunakan berbagai logam sebagai antikatoda pada tabung sinar X.
Moseley menyimpulkan bahwa ada perubahan yang teratur dari energi sinar X
sesuai dengan perubahan nomor atom dan bukan massa atom relatif. Dengan
demikian hukum periodik menjadi:“Sifat
unsur-unsur merupakan fungsi periodik dari nomor atom”
Hingga pertengahan abad ke-20, tabel periodik Moseley diakui sebagai tabel periodik modern. Pada 1940, Glenn Seaborg berhasil menemukan unsur transuranium, yaitu unsur dengan nomor atom 94–102. Penemuan tersebut menimbulkan masalah mengenai penempatan unsur-unsur transuranium dalam tabel periodik. Masalah itu akhirnya terpecahkan dengan cara membuat baris baru sehingga tabel periodik modern berubah menjadi seperti gambar berikut.
A.
B.
Suatu unsur
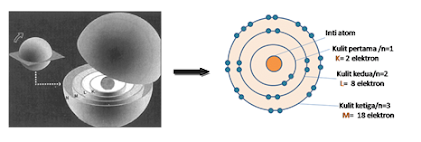
dalam sistem periodik di susun berdasarkan konfigurasi elektronnya, karena tiap
unsur memiliki konfigurasi elektron yang berbeda. Dari konfigurasi elektron,
jumlah kulit dan elektron valensi suatu unsur bisa diketahui. Adapun unsur-unsur
yang memiliki kesamaan dalam jumlah elektron valensi disusun dalam satu lajur
vertikal yang disebut golongan. Unsur-unsur yang berada dalam satu golongan
tersebut memiliki kemiripan sifat kimia dan fisika.
Tabel periodik
modern terdiri dari 8 golongan utama (golongan A) dan 8 golongan transisi (golongan B). Golongan-golongan tersebut dinamai sesuai dengan nomor kelompoknya, seperti golongan IA, IIB, IB dan
seterusnya. Bahkan golongan utama memiliki nama khusus, misalknya golongan IA
dinamai golongan alkali dan golongan VIIIA dinamai golongan gas mulia.
Dalam sistem
periodik unsur terdapat 7 lajur horizontal yang disebut periode. Dinamakan
periode karena sifat-sifat yang dimiliki unsur-unsur dalam satu periode berulang secara periodik.
Unsur-unsur yang memiliki jumlah kulit yang sama disusun dalam
satu periode.
Berikut kita pelajari Tabel Sistem
Periodik sederhana, yaitu mulai nomor atom 1 (hidrogen) sampai nomor atom 20
(kalsium) seperti ditunjukkan gambar 3.
Kedua puluh unsur ini termasuk unsur-unsur utama dan nomor golongannya dibubuhi
huruf A sedangkan pada unsur-unsur transisi dan nomor golngannya dibubuhi huruf
B.
Unsur-unsur yang terletak pada lajur tegak
disebut golongan. Golongan-golongan
diberi nomor I, II, III, dan seterusnya. Misalnya Golongan II terdiri dari
unsur-unsur berilium, magnesium, dan kalsium. Unsur-unsur dalam deret mendatar
disebut periode. Misalnya, delapan
unsur-unsur mulai natrium sampai argon terletak dalam periode.
Menentukan Letak Unsur dalam sistem Periodik Unsur Berdasarkan Konfigurasi Elektron Mekanika Kuantum
Elektron
valensi adalah elektron pada kulit terluar atau elektron yang dapat digunakan
untuk membentuk ikatan. Unsurunsur pada satu golongan mempunyai jumlah elektron
valensi yang sama. Ciri-ciri elektron valensi menurut golongannya dapat dilihat
pada tabel berikut
Hal
ini berarti bahwa:
- Apabila elektron terakhir suatu unsur mengisi orbital 4s atau 4p, maka unsur itu terletak pada periode 4.
- Apabila elektron terakhir dari suatu unsur mengisi orbital 4d, berarti unsur itu terletak pada periode 5.
- Apabila elektron terakhir dari suatu unsur mengisi orbital 4f, berarti unsur itu terletak pada periode 6.
Hubungan jumlah elektron pada orbital terakhir dengan nomor golongan adalah sebagai berikut.